10. Sınıf Kimya Ders Kitabı Sayfa 65-67 Cevapları Meb Yayınları
10. Sınıf Kimya Ders Kitabı Sayfa 65 Cevapları (MEB Yayınları)
1. Ünite: Etkileşim – Çalışma Yaprağı Cevaplarıx
Konu: Kimyasal Tepkime Denklemlerini Denkleştirme
1. Soru: Termit Tepkimesi Denkleştirme
Verilen Tepkimeler:
- Al + Fe₂O₃ → Fe + Al₂O₃ + ısı
- Al + Cu₂O → Cu + Al₂O₃ + ısı
Bu tepkimelere termit tepkimesi adı verilir. Termit tepkimelerinde alüminyum, metal oksitlerle tepkimeye girerek çok yüksek sıcaklıkta ısı açığa çıkarır. Bu tepkimeler demiryolu raylarının birleştirilmesinde, kaynak işlerinde ve elektrik iletkenlerinin onarımında kullanılmaktadır.
Denkleştirme Basamaklarının Uygulanması:
1️⃣ Tepken ve ürünlerdeki atom türlerini belirleyelim:
- Tepkime 1 için: Fe₂O₃’te 2 Fe ve 3 O atomu, Al₂O₃’te 2 Al ve 3 O atomu vardır.
- Tepkime 2 için: Cu₂O’da 2 Cu ve 1 O atomu, Al₂O₃’te 2 Al ve 3 O atomu bulunur.
2️⃣ Oksijen atomlarını denkleştirelim:
Her iki tepkimede de ürün ve tepkende oksijen sayısının aynı olması gerekir. Oksijen sayısına göre Al₂O₃’te 3 oksijen olduğundan uygun katsayılar eklenir.
3️⃣ Alüminyum ve metal atomlarını eşitleyelim:
Al atomu Al₂O₃ bileşiğinde 2 olarak bulunduğu için tepkimeye 2 Al yazılır.
Fe veya Cu atomları da buna göre dengeye getirilir.
Denkleştirilmiş Tepkimeler:
- 1. Tepkime: 2Al + Fe₂O₃ → 2Fe + Al₂O₃
- 2. Tepkime: 2Al + 3Cu₂O → 6Cu + Al₂O₃
Açıklama: Her iki tepkimede de kütlenin korunumu yasası sağlanmıştır.
- Her iki tarafta da C, O ve H atom sayıları eşittir.
- Alüminyum, oksitli bileşiğe girerek Fe ve Cu metallerini serbest bırakmıştır.
- Tepkime sonucunda ısı açığa çıkar, bu nedenle termit tepkimesi ekzotermik bir tepkimedir.
2. Soru: Potasyum Süperoksit (KO₂) Tepkimesi Denkleştirme
Verilen Tepkimeler:
- KO₂ + H₂O → KOH + O₂
- KO₂ + CO₂ → K₂CO₃ + O₂
Potasyum süperoksit (KO₂), süperoksit bileşikleri grubundandır. Bu bileşikler oksijen üretimi amacıyla kapalı sistemlerde kullanılır.
Örneğin; denizaltılarda, uzay mekiklerinde ve kapalı ortam solunum sistemlerinde, havadaki oksijen tükenince KO₂ tepkimesi sayesinde oksijen elde edilir. Ayrıca afet ve yangın durumlarında oksijen tüpleri yerine kullanıldığı da bilinmektedir.
Denkleştirme Basamaklarının Uygulanması:
1️⃣ Tepkime 1 (KO₂ + H₂O → KOH + O₂)
- Potasyum (K): 1
- Oksijen (O): 2 (KO₂) + 1 (H₂O) = 3
- Hidrojen (H): 2
Ürünlerde KOH ve O₂ olduğu için, oksijen atomlarını dengelemek amacıyla katsayılar eklenir.
Denkleştirilmiş hâli: 4KO₂ + 2H₂O → 4KOH + 3O₂
2️⃣ Tepkime 2 (KO₂ + CO₂ → K₂CO₃ + O₂)
- Potasyum (K): 1
- Karbon (C): 1
- Oksijen (O): 4 (KO₂’den) + 2 (CO₂’den) = 6
Bu durumda K ve O atomlarını eşitlemek için uygun katsayılar eklenir.
Denkleştirilmiş hâli: 4KO₂ + 2CO₂ → 2K₂CO₃ + 3O₂
Açıklama: Potasyum süperoksit hem nem (H₂O) hem de karbondioksit (CO₂) ile tepkimeye girdiğinde oksijen (O₂) üretir.
Bu tepkimeler kütlenin korunumu yasasına uygundur ve yaşam destek sistemlerinde oksijen kaynağı olarak görev yapar.
Tepkimeler sonucunda hem KOH (bazik madde) hem de K₂CO₃ (tuz) oluşur.
Sonuç: Bu çalışma yaprağında, iki farklı kimyasal tepkimenin denkleştirilmesi yapılmıştır:
- Termit tepkimeleri (metallerin oksitlerle ekzotermik tepkimesi)
- Potasyum süperoksit tepkimeleri (oksijen üreten tepkimeler)
Her iki durumda da atom sayısı korunmuş, kütlenin korunumu yasası sağlanmıştır.
Kimyasal tepkimelerin denkleştirilmesi, doğada ve endüstride enerji üretimi, oksijen elde etme ve kaynak işlemleri gibi birçok alanda uygulanmaktadır.
10. Sınıf Kimya Ders Kitabı Sayfa 66 Cevapları (MEB Yayınları)
Soru 3: Canlılar, yaşamlarını devam ettirmek ve çoğalmak için enerjiye ihtiyaç duyarlar. Bu nedenle aldıkları besinleri solunum ile parçalayarak enerjiye dönüştürürler.,
Oksijenli solunum sonucunda glikoz (C₆H₁₂O₆) molekülü, karbondioksit (CO₂) ve su (H₂O) moleküllerine kadar parçalanırken; oksijensiz ortamda tam parçalanma gerçekleşmez. Kullanılan enzimin türüne göre oksijensiz solunumda etil alkol (C₂H₅OH) veya laktik asit (C₃H₆O₃) oluşur.
Denkleştirilmiş Tepkimeler:
Oksijenli Solunum:
➡️ C₆H₁₂O₆ + 6O₂ → 6CO₂ + 6H₂O + enerji
Oksijensiz Solunum (Etil Alkol Fermantasyonu):
➡️ C₆H₁₂O₆ → 2C₂H₅OH + 2CO₂ + enerji
Oksijensiz Solunum (Laktik Asit Fermantasyonu):
➡️ C₆H₁₂O₆ → 2C₃H₆O₃ + enerji
Bu denklemler tam denkleştirilmiştir ve her iki tarafta da C, H, O atomları korunmuştur.
Kontrol Noktası – Biyodizel Oluşumu ve Yanması
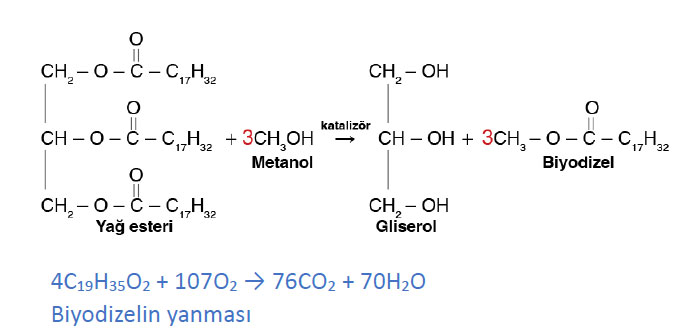
Soru: Alternatif enerji kaynağı olan biyodizel, bitkisel veya hayvansal atık yağlardan elde edilir. Yağlar, metanol (CH₃OH) veya etanol gibi kısa zincirli bir alkolle katalizör eşliğinde tepkimeye girerek biyodizel oluşturur.
Biyodizelin oluşum ve yanma süreci kütlenin korunumu kanunu çerçevesinde incelenir.
Cevap:
Biyodizel Oluşumu (Transesterifikasyon):
➡️ Yağ esteri + 3CH₃OH → 3CH₃OOC–C₁₇H₃₃ + C₃H₅(OH)₃
(1 trigliserit + 3 metanol → 3 biyodizel + 1 gliserol)
Biyodizel Yanması:
➡️ 2C₁₅H₃₀O₂ + 43O₂ → 30CO₂ + 30H₂O
Bu tepkimelerde kütlenin korunumu sağlanır. Giren ve çıkan tarafta C, H ve O atomlarının sayısı eşittir, dolayısıyla tepkimeler dengeye gelmiştir.
10. Sınıf Kimya Ders Kitabı Sayfa 67 Cevapları (MEB Yayınları)
Soru 2 – Çöktürme ile Yemek Tuzu Tayini
Soru: Gıda laboratuvarlarında NaCl çözeltisindeki Cl⁻ iyonları, AgNO₃ ile AgCl (beyaz çökelti) oluşturur. Cl⁻ tükendiğinde AgNO₃, indikatör K₂CrO₄ ile Ag₂CrO₄ (kahverengi çökelti) verir. Bu tepkimelerin kütlenin korunumu yasasına uygunluğunu sorgulayınız; gerekirse denkleştiriniz.
Kısa Cevap:
NaCl + AgNO₃ → AgCl (k) + NaNO₃ (denk)
2AgNO₃ + K₂CrO₄ → Ag₂CrO₄ (k) + 2KNO₃ (denk)
Ayrıntılı Cevap:
- İlk tepkimede Na, Ag, Cl ve NO₃⁻ sayıları iki tarafta eşittir, dolayısıyla denktir.
- İkinci tepkimede Ag atomları için 2 katsayısı gerekir: 2AgNO₃ + K₂CrO₄ → Ag₂CrO₄ + 2KNO₃; böylece K, Cr, O da korunur.
- Her iki tepkime de kütlenin korunumu ilkesini sağlar.
Soru 3 – Fosforik Asit (H₃PO₄) Eldesi
Soru: Fosforik asit eldesi için aşağıdaki iki basamak denkleştirilmemiştir. Denkleştiriniz.
- P₄ + O₂ → P₄O₁₀
- P₄O₁₀ + H₂O → H₃PO₄
Kısa Cevap:
P₄ + 5O₂ → P₄O₁₀
P₄O₁₀ + 6H₂O → 4H₃PO₄
Ayrıntılı Cevap:
- 1. basamakta O sayısını eşitlemek için 5O₂ gerekir.
- 2. basamakta H ve O’yu dengede tutmak için 6H₂O ve 4H₃PO₄ yazılır.
- Her iki basamakta da P, H, O atomları eşit olup kütle korunur.
Soru 4 – Kibritte P₄S₃ ve KClO₃ Tepkimesi
Soru :
a) Kibrit sürtünmeyle P₄S₃ ve KClO₃’ün tepkimesinden P₂O₅, KCl, SO₂ oluşur. Tepkimeyi yazınız.
b) Kütlenin korunumu için denkleştiriniz.
Kısa Cevap:
a) P₄S₃ + KClO₃ → P₂O₅ + KCl + SO₂
b) 3P₄S₃ + 16KClO₃ → 6P₂O₅ + 16KCl + 9SO₂
Ayrıntılı Cevap:
a) Ürünler verilene göre sembolik denklemi yazılır.
b) P için 6×P₂O₅ gerektiğinden sol tarafa 3P₄S₃ alınır (P=12). S’yi eşitlemek için 9SO₂ yazılır (S=9). K ve Cl’yi eşitlemek için 16KCl gerekir; bu da reaktifte 16KClO₃ gerektirir. O toplamı her iki tarafta 48 olur. Böylece tüm atomlar eşit ve denklem doğrudur.






Türkçe karakter kullanılmayan ve büyük harflerle yazılmış yorumlar onaylanmamaktadır.